Les céto-ynamides, des outils efficaces pour la synthèse d’hétérocycles azotés
Séminaire Chimie ED459
Dr. Laurence
Le Jeudi 13 Septembre 2018 à 14h
ENSCM, Amphithéâtre Godechot (campus Balard, 240 av. Émile-Jeanbrau)
(nouvelle date, report du 28 juin suite aux préavis de grèves SNCF)
Date de début : 2018-09-13 14:00:00
Date de fin : 2018-09-13 15:30:00
Lieu : ENSCM amphi Godechot (campus Balard, 240 av E. Jeanbrau)
Intervenant : Dr. Laurence
équipe LCOS Chimie Organique Synthétique, Institut de Chimie de Strasbourg, UMR 7177 CNRS, Université de Strasbourg
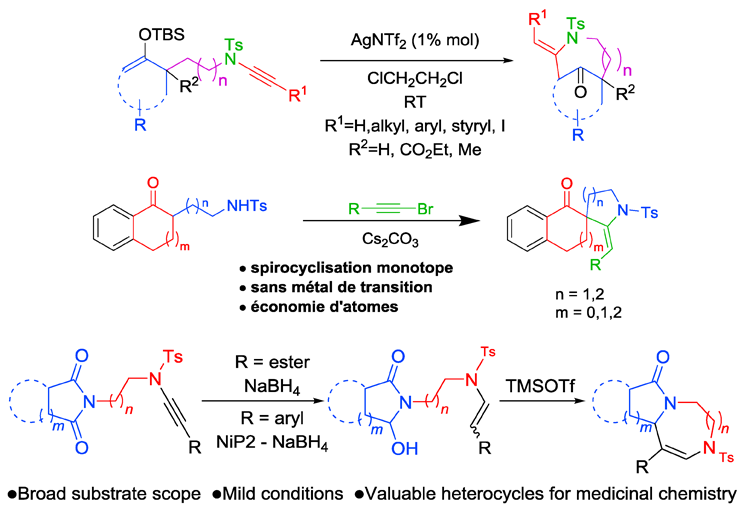
La cycloisomérisation de cétoalcynes fonctionnalisées en présence de bis-triflimidate d’argent permet d’accéder aux composés spirocycliques correspondants.[1] Dans le but d’élargir l’étude de réactivité menée sur ces composés, nous avons étudié la réactivité de céto-ynamides vis à vis de métaux. Comme l’éther d’énol silylé cinétique est obtenu de manière exclusive, des énamides pontés originaux ont été isolés à température ambiante avec d’excellents rendements.[2] Une réaction de spirocyclisation one pot au départ de cétosulfonamide a ensuite été développée pour accéder à des aza-spiros que l’on retrouve notamment dans des alcaloïdes naturels de type Aspidosperma. De bons rendements en composé spiraniques sont observés au départ de dérivés céto-sulfonamides de type indanone et indolone en présence d’un excès de carbonate de césium.[3] La réaction de spirocyclisation présentée tolère de nombreux substituants acétyléniques ainsi que diverses cycloalcanones. La réduction d’imides N-fonctionnalisés avec un ynamide, permet d’accéder à des énamides tertiaires substitués avec des précurseurs d’N-acyl imminiums. En présence d’un acide de Lewis, ces composés cyclisent pour former des diazépines, des diazocanes ou encore des diazonanes sous-structures de produits naturels.[4]
Références
1. C. Schäfer, M. Miesch, L. Miesch, Chem. Eur. J. 2012, 18, 8028–8031.
2. C. Heinrich, I. Fabre, L. Miesch, Angew. Chem. Int. Ed. 2016, 55, 5170–5174.
3. F. Beltran, I. Fabre, I. Ciofini, L. Miesch, Org. Lett. 2017, 19, 5042–5045.
4. L. Andna, L. Miesch, Org. Lett. 2018, article ASAP, DOI 10.1021/acs.orglett.8b01407.
Contact local IBMM : Dr. Xavier