Nouvelle stratégie de synthèse de dimères ribonucléosidiques avec un lien amide à partir du D-xylose
Séminaire Chimie ED459
Prof. Jacques
[rouge]SÉMINAIRE ANNULÉ (alerte sanitaire covid)[/rouge]
Le Jeudi 12 Novembre 2020 à 14h
Institut Européen des Membranes, salle de conférences (campus Balard Bât. 40, 300 avenue Émile-Jeanbrau)
Date de début : 2020-11-12 14:00:00
Date de fin : 2020-11-12 15:30:00
Lieu : IEM salle de conférences (300 av. Jeanbrau)
Intervenant : Prof. Jacques
CEISAM Chimie Et Interdisciplinarité : Synthèse, Analyse, Modélisation, UMR 6230, CNRS, Université de Nantes
Les nucléosides existent à l’état naturel, ce sont les éléments constitutifs des acides nucléiques (ARN et ADN). Ils représentent aussi une famille de molécules synthétiques ayant des applications en thérapie génique dans les stratégies antisens et ARN interférents. Des modifications chimiques sont indispensables pour garantir une résistance de ces oligonucléotides vis-à-vis des nucléases et diminuer leur caractère ionique, tout en maintenant leur affinité et leur spécificité pour l’ARN messager cible.[1,2]
Différentes modifications ont été envisagées dans la littérature dont la modification du lien internucléosidique, et notamment le remplacement du lien phosphodiester par un lien amide qui s’impose comme une modification de choix mimant parfaitement le lien phosphodiester.[3] Différentes approches synthétiques ont été étudiées dans la littérature à partir soit de nucléosides soit de dérivés ribosiques. Cependant dans ces stratégies, la formation du lien amide a toujours lieu entre deux unités nucléosidiques.[4]
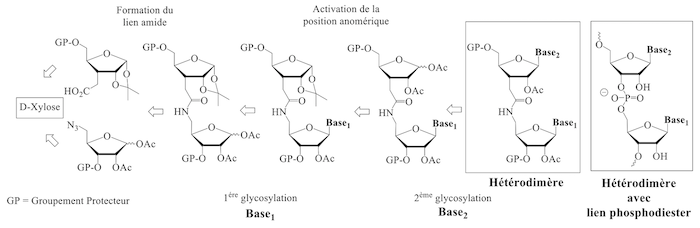
Nous présentons ici une stratégie de synthèse innovante et efficace [5] à partir d’un précurseur peu onéreux le D-xylose (voir figure ci-dessous). Notre stratégie passe par des squelettes de type dimères ribosidiques avec un lien amide. Ceux-ci judicieusement protégés, permettront d’accéder par simple glycosylation soit à des homodimères ribonucléosidiques soit à des hétérodimères ribonucléosidiques (voir schéma ci-dessous).
References
1. Pour une revue sur ce sujet, voir D. Mutisya, C. Selvam, B. D. Lunstad, P. S. Pallan, A. Haas, D. Leake, M. Egli, E. Rozners, Nucleic Acids Res. 2014, 42, 6542–6551.
2. J. Xu, Y. Liu, C, Dupouy, J. Chattopadhyaya, J. Org. Chem. 2009, 74, 6534–6554.
3. A. De Mesmaeker, A. Waldner, J. Lebreton, P. Hoffmann, V. Fritsch, R. M. Wolf, S. M. Freier, Angew. Chem. Int. Ed. 1994, 33, 226–229.
4. C. Selvam, S. Thomas, J. Abbott, S. D. Kennedy, E. Rozners, Angew. Chem. Int. Ed. 2011, 50, 2068–2070 et littérature citée.
5. L. Arzel, D. Dubreuil, F. Dénès, V. Silvestre, M. Mathé-Allainmat, J. Lebreton, J. Org. Chem. 2016, 81, 10742–10758.
Contact local IBMM : Dr. Françoise