L’activité de l’équipe est centrée sur le développement d’un dispositif médical (Figure 1) dans le traitement des cancers solides (notamment le cancer du sein) et plus globalement dans l’étude de la migration cellulaire des cellules tumorales in vivo et in vitro à partir de molécules, d’une matrice chimique et d’une puce microfluidique.
Notre équipe travaille également sur les syndromes myéloprolifératifs (proliférations anormales des cellules sanguines dans la moelle osseuse) et est aujourd’hui laboratoire de référence dans l’exploration des syndromes myéloprolifératifs.
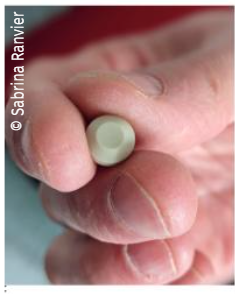
Figure 1 : Photographie de notre dispositif médical
Nos Thématiques
Capture et Piégeage des cellules métastatiques (CAPDCM)
Le traitement des cancers solides et en particulier du cancer du sein repose sur des thérapies conventionnelles tels que la chirurgie, la radiothérapie, la chimiothérapie et plus récemment la thérapie ciblée. Malgré cela, en 2018, on estime que 627 000 femmes sont décédées dans le monde, du cancer du sein. Notre équipe pluridisciplinaire (biologie, microfluidique et chimie) propose une nouvelle approche thérapeutique à destination des cancers solides opérables comme le cancer du sein. Notre stratégie « attirer et piéger » consiste en une combinaison d’innovation permettant à une puce microfluidique biocompatible (diamètre inférieur à 1 cm) d’attirer les cellules cancéreuses et de les piéger. A la fin de la période active, le dispositif médical implantable (DM) pourra être retiré. Notre DM sera implanté pendant ou juste après la biopsie. Il permettra ainsi de couvrir la phase pré-opératoire (2 à 3 mois), péri-opératoire (2 jours) et post opératoire (2 mois). Au cours de ces différentes phases de nombreuse cellules tumorales peuvent quitter la tumeur primaire et se propager dans le tissu environnant et dans d’autres organes et être à l’origine de la recidive des patient(e) s.
Développement d’une plate-forme d’analyse de molécules et de leur matrice chimique dans l’attraction des cellules tumorales
En partenariat avec l’équipe du Dr Benoît Charlot (IES), le Dr Laurent Henry développe une puce microfluidique multicanaux in vitro permettant d’analyser le pouvoir attractant de molécules (avec ou sans matrice chimique) sur des cellules tumorales humaines.
La finalité étant d’étudier de nouvelles cytokines ou molécules ayant un pouvoir attractant pour les inclure dans notre dispositif médical développé dans la thématique 1 (ci-dessus).
Caractérisation fonctionnelle des mutations des gènes associés aux néoplasies myéloprolifératives (Laboratoire labélisé de référence nationale dans l’exploration des syndromes myéloprolifératifs).
Ce projet de recherche est un projet clinique dans la continuité de l’activité biologique du laboratoire de Cytologie Clinique et Cytogénétique du CHU de Nîmes. Il s’inscrit dans le laboratoire labélisé laboratoire de référence national dans l’exploration des syndromes myéloprolifératif. Depuis 2019, nous analysons systématiquement les demandes de recherche de mutation dans le cadre des Syndromes MyéloProlifératifs (SMP) à l’aide d’un panel qui cible les gènes majeurs, JAK2, cMPL, CALR et un gène « pronostique » ASXL1, sur tous les exons. Cela nous a permis de décrire de très nombreux variants, pour la plupart non décrit dans les bases de données ou la bibliographie. Deux gènes concentrent une grande diversité de variants inédits, cMPL et ASXL1. Compte tenu de l’effet phénotypique de cMPL (récepteur de la thrombopoïètine, TPO) sur les pathologies qui nous intéressent, nous avons décidé de nous focaliser sur l’étude de ces variants. Le but de ce projet est de mettre en place une capacité d’analyse des variants générés par l’activité de « routine » du laboratoire.










